文献进展
文献进展
NAT REV GASTRO HEPAT :2012年肝癌肝移植研究进展源自:丁香园
《自然评论:胃肠病学与肝脏病学》杂志 (Nat Rev Gastroenterol Hepatol)在2013年二月版刊登了一篇关于2012年肝癌肝移植研究进展的年度综述,文章作者是来自中国香港大学外科系的Chung-Mau Lo。作者指出,通过改进患者选择标准以及革新新辅助疗法,肝癌肝移植的预后日益改善。此外,供体安全性的提高和肝左叶活体肝移植的广泛应用或许能使更多的患者从移植中获益。
在2012年,随着病患选择标准、新辅助疗法以及活体肝移植方面取得的进展,肝癌作为肝移植适应症的理念仍在不断发展深化。患者的存活率日益提高,而且随着病患选择和治疗的进展,有更多的肝癌患者可以进行肝移植。
2012年肝癌肝移植关键进展
-血清甲胎蛋白作为循环生物标志物可提高预测肝细胞癌肝移植后复发情况的准确性
-基于基因表达分子水平研究的组织生物标志物与肿瘤生物学相关联
-不可切除性肝门部胆管癌患者在肝移植前接受新辅助放化疗可提高生存率,这为他们在器官分配中的优先权提供了依据
-随着供体安全性的提高和左叶肝活体移植的广泛应用,或许会有更多的肝癌患者能从肝移植中获益
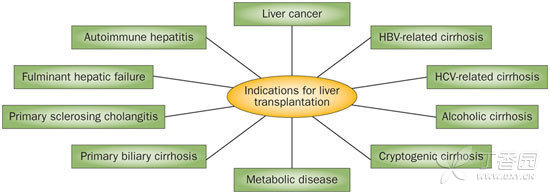
图1 肝移植的常见适应症
自1963年Thomas Starzl首次尝试人体肝移植这一历史性时刻以来,至2012年刚好整整过去半个世纪。从那以后,肝移植术从最初作为患者最后选择的试验性手术逐渐发展成为挽救生命的高成功率手术,一年及五年生存率分别超过85%和70%。肝癌是行肝移植手术的首选适应症之一(图1)。但在世界范围内器官短缺的情况下,肝癌肝移植由于其复发风险以及不良转归风险而广受争议。欧洲肝移植注册数据库(ELTR)显示,肝癌在肝移植适应症中所占的比例出现实质性改变,从20世纪80年代的50%下降至90年代的10%。在过去10年中,这一适应症(肝癌)所占的比例从10%线性增加至20%。在这段时间里,患者的一年生存率也提高了36%,这要归功于病患选择的改进,而非疗法的改善。在本文中,我们将着重介绍了几项有可能进一步改善临床结果并扩大肝癌肝移植应用范围的研究。
血清甲胎蛋白可为肝移植筛选合适的肝细胞癌患者
肝细胞癌(HCC)是最常见的原发性肝癌,也是肝移植的常见适应症。在过去15年中,肝癌肝移植预后的改善及肝移植比例的增加主要得益于米兰标准(Milan criteria;1996年第一次出版;单个肿瘤直径 ≤5 cm,或肿瘤少于3个,每个直径≤3 cm,无证据表明侵入血管或出现肝外转移)的应用。然而,现有证据提示,恶性肿瘤的转移潜能取决于其本身固有的生物学特性,或许与其大小和数量无关。国际HCC肝移植共识会议建议,仍将米兰标准作为选择患者或决定优先次序的基准,同时,血清甲胎蛋白(α-fetoprotein,AFP)作为血清生物标志物或可为基于影像学的米兰标准补充预后信息。
法国肝移植研究小组将血清AFP、肿瘤数量和肿瘤大小作为3个独立的预后因素,三者共同构成模型的一部分,用于预测移植后的复发情况。研究人员将这3个变量各自的得分相加后得到一个分数,并以“2分”作为界限值将患者分为高复发风险组(分数>2)和低复发风险组(分数≤2),二者的五年复发率分别是50.6%和8.8%。
对位于米兰标准之内及之外的患者亚群,AFP模型均能给出预后预测值。净重新分类结果表明,超出米兰标准且未复发患者中的74%若按AFP模型进行分类,可列为低风险组,这部分患者是合格的肝移植人选。值得注意的是,AFP模型适用于为进行进一步筛选而处于等待阶段的正经历重新评估的患者(处于病变降期或由于肿瘤进展而中途退出)。血清AFP能够给出可重复的结果,是一种简单可靠的生物标志物,必须将其纳入临床决策过程,为肝移植选择合适的HCC患者。
miRNA表达谱可预测肝癌肝移植的预后情况
MicroRNA(miRNA,微小核糖核酸)的表达谱或许也可用于预测肿瘤生物学。当将肝肿瘤组织的67个miRNAs表达谱作为生物标志物时,成功鉴别出12例在米兰标准之内却复发HCC患者中的9例(9/12),以及11例超出米兰标准之外却没有出现复发患者中的8例(8/11)。尽管这一生物矩阵(miRNA表达谱)或许能够提高米兰标准的准确性,但是,与传统组织病理学特征(诸如微血管转移或细胞分化)相比,这一分子水平研究(基因表达)的优势还有待确定。
此外,尽管并非完全不可能,但是想要通过针刺活检获得适量组织以用于miRNA扩增和生物标志物测试还是很困难的。活组织检测所造成的风险(尤其是那些代偿失调性肝硬化合并凝血障碍、门静脉高压和腹水的患者)是相当大的。因此,除了在最初进行过肝切除后因复发而等待补救性肝移植的情况下,将组织生物标志物合并作为病患选择标准之一的潜在价值有限。
Fuks等人的研究表明,这一策略与在意向治疗基础上行首次移植的生存率相近。尽管如此,许多肝切除后复发的患者可能并不符合移植要求5,而且补救性肝移植已被证明是预测复发的强有力指标,预测效果甚至比血清AFP和微血管转移更好。对肝切除标本进行组织学和生物标志物检测,有可能为临床决策提供有价值的信息,从而在复发前更早地行补救性移植或是在复发后决定不进行移植。
新辅助化放疗序贯肝移植可治疗不可切除性肝门部胆管癌
肝门部胆管癌是第二大常见的原发性肝癌。大部分患者出现局部晚期癌症且无法行根治性切除术,即使有可能切除,复发率也很高。人们最初希望通过肝移植来克服切除术的局限性,但这一热情很快被患者的不良预后浇灭了。因此,直到有报道称在肝移植前进行新辅助放化疗方案得到令人鼓舞的成果之前,肝门部胆管癌一直被认为是肝移植的禁忌症。自2009年7月以来,联合器官共享网络/器官获取与移植网络(UNOS/OPTN)批准为那些完成新辅助放化疗方案的患者实行终末期肝病模型(MELD)例外评分。7MELD例外评分被人为地设定至等同于当前的HCC指定分数,表示每3个月候补名单的预计死亡率上升10%。
美国的一项多中心研究证明,对于不可切除性的肝门部胆管癌患者而言,在肝移植前进行新辅助放化疗是有效的,这为这些患者通过指定MELD例外评分而获得器官分配优先权提供了依据。7在287例患者中,71例(25%)在4.6个月(中位值)后退出;每3个月的平均退出率为11.5%,这支持了当前的UNOS/OPTN政策——MELD例外评分。
在214例完成新辅助治疗后进行肝移植的患者中,五年无病生存率达65%,与其他恶性或良性肝病的预后相当。UNOS/OPTN的MELD例外标准(肿瘤大小>3 cm,移植时肿瘤转移或直接腹膜腔内肿瘤活检)是唯一具有统计学显著性的预后预测因子(HR 2.98)。那些符合标准的患者五年无病存活率为72%。这项研究是新辅助疗法针对肝门部胆管癌疗效的最佳现有证据,也支持了接收并优先安排这些患者行肝移植术的做法。由于这一疾病的稀有性及出于伦理考虑,几乎不可能安排肝门部胆管癌患者进行随机试验。
活体肝移植或可克服尸源供体器官短缺问题
研究人员仍在继续努力改善预后并使更多罹患肝癌的患者能从肝移植中获益,与此同时,由于肝移植是一场零和博弈(一名患者获得肝移植意味着另一名患者死亡),尸源供体器官的短缺问题也变得更加严重。活体肝移植(LDLT)可以提供无限的肝移植体,并且使肝移植转变为非零和博弈。早期进行LDLT可以避免因肿瘤进展或新辅助疗法并发症所致肝功能衰竭而中途退出。在那些因肝门部胆管癌而进行新辅助治疗的患者中,29%的供体肝来源于活体供者,这比美国LDLT的总体比例(5%)高出许多。
亚洲的两项研究发现,捐赠左肝比捐赠右肝更加安全,而且成年受体能够达到极好的临床结果。当所需移植物的最小尺寸每减少5%(可能通过改进手术技巧、应用门静脉血流调制和改进手术后护理以避免小肝综合征来实现),左肝移植的数量就可以增加一倍,同时也降低捐献者的风险。
通过改进患者选择以及革新新辅助治疗,肝癌肝移植的预后日益改善。供体安全性的提高和肝左叶LDLT的广泛应用,这二者或许能使更多的患者从移植中获益。